阿司匹林在动脉粥样硬化性心血管疾病中的临床应用
为规范阿司匹林在动脉粥样硬化性心血管疾病(atherosclerotic cardiovascular disease,ASCVD)中的应用并提高我国广大临床医师对于阿司匹林的认识,中华医学会老年医学分会牵头组织心脏病学、内分泌学、神经病学、血液病学、消化病学与肾脏病学相关专家,在"阿司匹林在动脉粥样硬化性心血管疾病中的临床应用:中国专家共识(2005)"的基础上,回顾近10年的循证医学证据,参考国内以及欧美发达国家相关指南/共识和建议,结合中国国情和临床现状,充分讨论并更新形成本共识。
阿司匹林预防ASCVD血栓形成的机制与历史
动脉粥样硬化斑块破裂暴露血管内皮下胶原和von Willebrand因子(vWF),在炎症细胞产生的趋化、黏附以及细胞因子作用下,血小板黏附在破裂处,黏附后血小板活化并释放胶原、vWF、二磷酸腺苷(ADP)、血栓素A2(TXA2)和凝血酶等使血小板聚集,并和凝血瀑布终产物纤维蛋白交联,最终导致血栓形成。血栓形成过程中,血小板聚集是核心步骤,TXA2是活化血小板的重要因素。
阿司匹林的作用机制与剂量有关:<100 mg/d时,通过共价键结合,不可逆地将血小板花生四烯酸通路的环氧合酶1(COX-1)丝氨酸残基Ser 530乙酰化,最终抑制血小板生成TXA2。这一抑制作用持续血小板的整个生命期(8 ~ 9 d),临床表现为出血时间延长。此外还可抑制中性粒细胞来源的血小板活化;抑制内皮前列环素的合成,使一氧化氮(NO)合成减少;300 mg/d可以保护低密度脂蛋白(LDL)免于氧化修饰,抑制动脉粥样硬化的进展;>650 mg/d则通过抑制COX-1和COX-2,阻断前列腺素合成,主要发挥止痛、退热和抗炎作用。
临床试验与净获益
1临床试验:
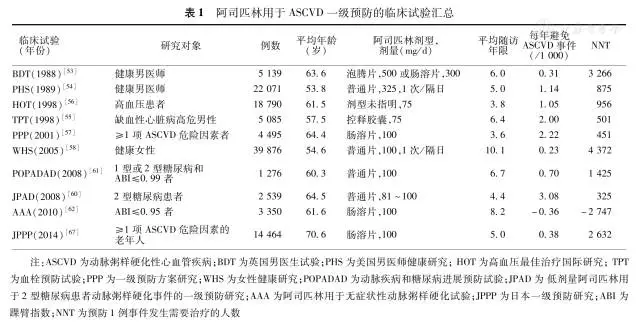
已完成的阿司匹林ASCVD一级预防试验的汇总见表1。
2净获益:
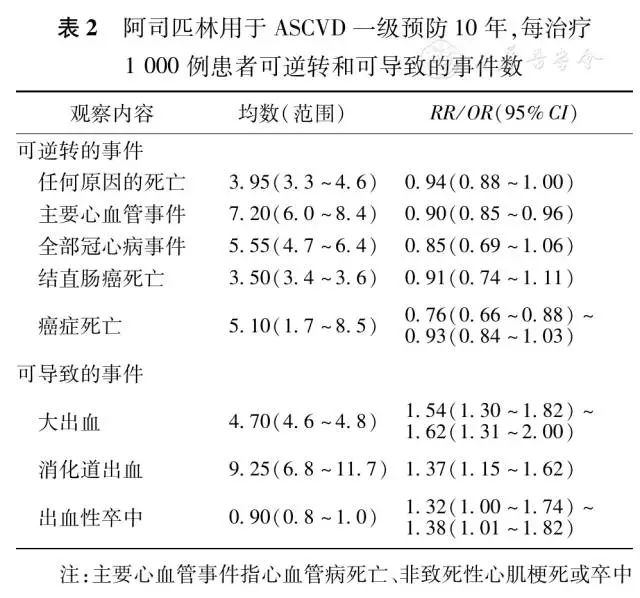
阿司匹林一级预防针对的人群为无冠心病或卒中病史的成年人,这部分人群事件的发生率低,缺血及出血风险权衡的难度大,现有的获益及风险评估方法的准确性差。研究显示,增龄(每增加10岁)、种族、男性、糖尿病、目前吸烟以及高血压(收缩压每升高20 mmHg,1 mmHg=0.133 kPa)均与出血相关,而这些因素也都是公认的心血管事件危险因素,即心血管事件风险越大,阿司匹林治疗的获益越大,同时出血风险也越大。只有在预防心血管病事件的获益明显超过出血风险时,使用阿司匹林进行一级预防才有意义。阿司匹林治疗获益和风险的权衡取决于下列4个主要危险因素:出血风险、阿司匹林治疗依从性、基础心血管疾病发病风险以及年龄。
近期系统性回顾分析显示,常规剂量应用阿司匹林作为ASCVD一级预防在获益和风险方面能够达到较好的平衡(表2)。
评估基线ASCVD风险
ASCVD的发生是多个危险因素复杂交互作用的共同结果。个体发生ASCVD的风险不仅取决于某一危险因素的水平,更取决于同时存在的危险因素的数目和水平。20世纪末以来,国际上各种ASCVD防治指南均强调一级预防中总体风险评估和危险分层治疗策略的重要性。基于预防ASCVD事件获益需大于出血风险的原则,ASCVD风险的基线评估是正确使用阿司匹林进行一级预防的前提。
为便于应用和推广,本共识参照相关指南,引用适合国人的10年ASCVD发病风险评估流程图并稍加简化(图1)。按照性别、年龄、是否吸烟、是否患有低HDL-C血症、血胆固醇水平(TC或LDL-C水平)和血压分级6个因素不同组合,估算10年ASCVD发病平均风险。
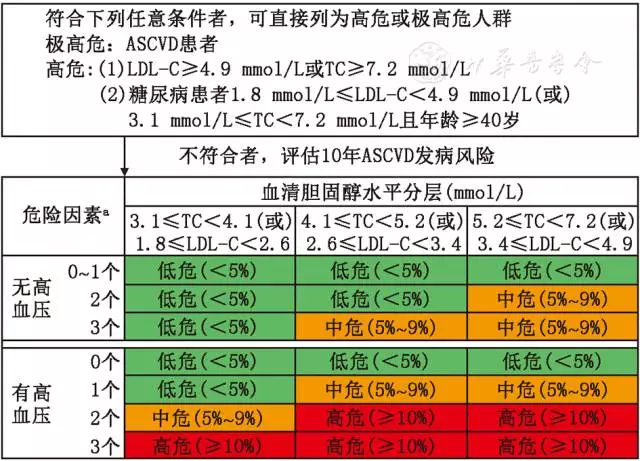
图1 10年动脉粥样硬化性心血管疾病(ASCVD)风险评估流程图
注:a包括吸烟、低HDL-C及男性≥45岁或女性≥55岁
03
阿司匹林用于中国人群ASCVD一级预防的推荐意见
目前欧美主要指南对于阿司匹林用于ASCVD一级预防的推荐意见详见附录1。
阿司匹林在ASCVD二级预防中的作用
01
临床试验与净获益(略)
02
阿司匹林用于中国人群ASCVD二级预防的推荐意见
1冠心病:
(1)稳定性冠状动脉疾病(SCAD):
■所有无禁忌证者,均应口服阿司匹林75~100 mg/d长期治疗(Ⅰ,A);不能耐受者用氯吡格雷75 mg/d(Ⅰ,B)。
■择期支架植入术前服用阿司匹林负荷量100~300 mg,其后100 mg/d维持(Ⅰ,B)。
(2)NSTE-ACS:
■所有无禁忌证者初始口服阿司匹林负荷量100~300 mg,75~100 mg/d长期维持(Ⅰ,A);不能耐受者,可用氯吡格雷(300~600 mg负荷量,75 mg/d维持)替代(Ⅰ,B)。
■中高危及拟行早期经皮冠状动脉介入治疗(PCI)者:
•入院后(诊断性血管造影前),尽快开始双联抗血小板治疗(Ⅰ,A)。
•PCI术前:①已接受长期阿司匹林治疗者,应在术前口服阿司匹林100 ~ 300 mg(Ⅰ,B);②以往未服用阿司匹林者,应在PCI术前至少2 h,最好24 h前给予阿司匹林300 mg口服(Ⅰ,B);③在阿司匹林基础上加1种P2Y12受体拮抗剂,除非存在禁忌证(如出血风险较高)(Ⅰ,A),选择包括替格瑞洛(负荷量180 mg,维持量90 mg,2次/d)(Ⅰ,B)、氯吡格雷(负荷量300~600 mg,维持量75 mg/d)(Ⅰ,B)。
•PCI术后:①置入金属裸支架(BMS)者双联抗血小板治疗(DAPT)至少4周(Ⅰ,A);因计划接受择期非心脏外科手术而置入BMS或经皮冠状动脉腔内成形术(PTCA)的患者,术后DAPT 4~6周(Ⅱa,B);出血风险高,不能耐受12个月DAPT,或12个月内可能中断DAPT而置入BMS或行PTCA的患者,术后DAPT 4~6周(Ⅰ,B);②置入药物洗脱支架(DES)者DAPT至少6个月(Ⅰ,B);高出血风险者可考虑缩短(<6个月)(Ⅱb,A);高出血风险,需接受不能推迟的非心脏外科手术或同时口服抗凝剂治疗者,可缩短至1~3个月(Ⅱb,C);缺血高危、出血低危的患者,DAPT可维持12个月以上(Ⅱb,A)。
■早期保守治疗者:入院后迅速开始阿司匹林及抗凝治疗,并加用氯吡格雷[负荷量后每日维持量,至少1个月(Ⅰ,A),最好12个月(Ⅰ,B)];低危患者继续长期服用阿司匹林(Ⅰ,A)。
■拟行冠状动脉旁路移植术(CABG)者:
•术前:阿司匹林100~300 mg /d(Ⅰ,A)。正在服用阿司匹林的患者,术前不需停药,特别对于病情不稳定的患者(Ⅰ,A)。
•术后:①术前未服用阿司匹林者,术后6 h内开始口服,100~300 mg/d,此后长期口服(Ⅰ,A);有禁忌证者,口服氯吡咯雷75 mg/d或替格瑞洛60~90 mg,2次/d替代(Ⅱa,C);②非体外循环CABG术后,阿司匹林75~150 mg/d联合氯吡格雷75 mg/d治疗1年(Ⅰ,A)。存在氯吡格雷抵抗者,建议使用新型抗血小板药物;③体外循环CABG术后,可以考虑阿司匹林联合氯吡格雷DAPT 1年(Ⅱb,A);④术后单一抗血小板治疗,阿司匹林300 mg/d优于75 mg/d(Ⅱa,A);⑤术后阿司匹林与普拉格雷或替格瑞洛合用,优于与氯吡格雷合用(Ⅱa,B);⑥PCI后的CABG患者,按照对PCI患者的建议行DAPT。
(3)STEMI:
■如无禁忌,立即口服水溶性阿司匹林或嚼服肠溶性阿司匹林300 mg(Ⅰ,B),继以75~100 mg/d长期维持(Ⅰ,A)。
■在使用阿司匹林的基础上:
•接受溶栓治疗者:①尽快口服氯吡格雷负荷量300 mg(年龄≤75岁)或75 mg(年龄>75岁),或替格瑞洛负荷量180 mg(适合缺血高危和氯吡格雷耐药倾向的患者)(Ⅰ,A);②溶栓后继续坚持DAPT,阿司匹林75~100 mg/d,长期维持;氯吡格雷75 mg/d或替格瑞洛90 mg,2次/d,维持12个月(Ⅰ,A)。
•接受直接PCI者(特别是置入DES者):应给予替格瑞洛负荷量180 mg,以后90 mg,2次/d,至少12个月(Ⅰ,B)或氯吡格雷负荷量600 mg,以后75 mg/d维持,至少12个月(Ⅰ,A)。
•接受挽救性或延迟性PCI者,参照直接PCI用药。
•接受CABG治疗者,参照针对NSTE-ACS患者的建议。
•未接受再灌注治疗的STEMI患者,可给予任何1种P2Y12受体拮抗剂:氯吡格雷负荷量600 mg,75 mg/d维持或替格瑞洛90 mg,2次/d,至少12个月(Ⅰ,B)。
(4)合并心房颤动需要持续抗凝治疗的直接PCI患者,应用氯吡格雷(负荷量600 mg,75 mg/d维持)(Ⅱa,B)。
2非心源性卒中或TIA
(1)给予口服抗血小板药物而非抗凝药物预防卒中复发及其他心血管事件(Ⅰ,A)。
(2)阿司匹林50~325 mg/d或氯吡格雷75 mg/d单药治疗均可作为首选抗血小板药物(Ⅰ,A);阿司匹林单药最佳剂量为75~150 mg/d。阿司匹林(25 mg)+缓释型双嘧达莫(200 mg),2次/d或西洛他唑100 mg,2次/d,均可作为阿司匹林和氯吡格雷的替代治疗(Ⅱa,B)。
(3)发病在24 h内,具有卒中高复发风险[ABCD2(A年龄;B血压;C临床症状;D症状持续时间、糖尿病)评分≥4分]的急性非心源性TIA或轻型缺血性卒中患者[国立卫生研究院卒中量表(NIHSS)评分≤3分],应尽早给予阿司匹林联合氯吡格雷治疗21 d(Ⅰ,A)。但应严密观察出血风险。此后可单用阿司匹林或氯吡格雷作为缺血性卒中长期二级预防一线用药(Ⅰ,A)。
(4)发病30 d内伴有症状性颅内动脉严重狭窄(狭窄率70%~99%)者,应尽早给予阿司匹林联合氯吡格雷治疗90 d(Ⅱa,B)。此后阿司匹林或氯吡格雷单用作为长期二级预防一线用药(Ⅰ,A)。
(5)伴有主动脉弓动脉粥样硬化斑块证据者,推荐抗血小板及他汀类药物治疗(Ⅱa,B)。
(6)不推荐常规长期应用阿司匹林联合氯吡格雷抗血小板治疗(Ⅲ,A)。
3心源性卒中
(1)非瓣膜病性心房颤动:
■CHA2DS2-VASc评分为0者可不予抗栓治疗(Ⅱa,B)。
■CHA2DS2-VASc评分为1者,不予抗栓,口服抗凝药物或阿司匹林均可(Ⅱb,C)。
■CHA2DS2-VASc评分≥2者应长期口服华法林,调整药物剂量使国际标准化比值(INR)维持在2.0~3.0(Ⅰ,A);评分≥2且合并终末期肾病[内生肌酐清除率(CrCl)<15 ml/min]或在血液透析者,应用华法林进行抗凝是合理的(INR 2.0~3.0)(Ⅱa,B);评分≥2且合并冠心病的患者,行PCI治疗时应尽量选择BMS,以减少术后联合抗栓治疗的时间(Ⅱa,C)。
■伴有心房颤动的缺血性卒中或TIA患者,若不能接受口服抗凝药物治疗,推荐应用阿司匹林单药治疗(Ⅰ,A),也可选择阿司匹林联合氯吡格雷抗血小板治疗(Ⅱa,B)。
■对SCAD合并CHA2DS2-VASc评分≥2分、HAS-BLED≤2分的心房颤动患者,建议置入BMS或新一代DES后,口服抗凝药物加阿司匹林100 mg/d、氯吡格雷75 mg/d至少1个月,然后口服抗凝药物加阿司匹林100 mg/d或氯吡格雷75 mg/d持续1年(Ⅱa,C)。
■对ACS合并心房颤动患者,如HAS-BLED评分≤2分,建议不考虑支架类型,均口服抗凝药物加阿司匹林100 mg/d、氯吡格雷75 mg/d 6个月,然后口服抗凝药物加阿司匹林100 mg/d或氯吡格雷75 mg/d持续至1年(Ⅱa,C)。1年以后若无冠状动脉事件可长期单用口服抗凝药。
■对HAS-BLED评分≥3分需口服抗凝药物的冠心病患者(包括SCAD和ACS),建议不考虑支架类型,口服抗凝药物加阿司匹林100 mg/d、氯吡格雷75 mg/d至少1个月,然后改为口服抗凝药物加阿司匹林100 mg/d或氯吡格雷75 mg/d(持续时间根据临床具体情况而定)(Ⅱa,C)。
(2)心脏瓣膜病:
■已使用足量华法林抗凝治疗的风湿性二尖瓣疾病患者,治疗过程中仍出现缺血性卒中或TIA时,可加用阿司匹林抗血小板治疗(Ⅱa,B)。
■不伴有心房颤动的非风湿性二尖瓣病变或其他瓣膜病变(局部主动脉弓、二尖瓣环钙化、二尖瓣脱垂等)的缺血性卒中或TIA患者,可以考虑抗血小板治疗(Ⅱa,B)。
(3)人工瓣膜置换后:
■应用抗凝药物仍发生缺血性卒中或TIA而无出血高风险者,在华法林基础上可加阿司匹林100 mg/d,保持INR 2.0~3.0(Ⅱb,B)。
(4)卵圆孔未闭(PFO):
■伴有PFO的缺血性卒中或TIA患者,如无法接受抗凝治疗,可予抗血小板治疗(Ⅰ,B)。
■PFO伴有静脉源性栓塞的缺血性卒中或TIA患者,推荐抗凝治疗(Ⅰ,A)。
4缺血性卒中急性期
(1)不符合溶栓适应证且无禁忌证者,发病后尽早口服阿司匹林150~300 mg/d(Ⅰ,A),急性期后50~325 mg/d(Ⅰ,A)。
(2)溶栓治疗者,阿司匹林等抗血小板药物应在溶栓后24 h开始使用(Ⅰ,B)。
(3)对不能耐受阿司匹林者,口服氯吡格雷等其他抗血小板药物(Ⅲ,C)。
5外周动脉疾病(PAD)
(1)有症状的PAD患者,长期用阿司匹林75~300 mg/d或氯吡格雷75 mg/d(Ⅰ,A)。
(2)ABI≤0.90或有颈动脉粥样斑块狭窄的无症状PAD患者,可用上述抗血小板药物(Ⅱa,C)。
(3)除心血管事件发生风险高且出血风险低或已行下肢血运重建术的有症状的PAD患者外,一般不推荐联合应用阿司匹林和氯吡格雷(Ⅱb,B及Ⅱb,C)。
大多数欧美指南均一致认可阿司匹林在急性心血管病治疗及其二级预防中的基石地位,推荐在疑及相关诊断时即可尽早开始阿司匹林治疗并在多数情况下长期使用(见附录2)。

阿司匹林在ASCVD预防中的注意事项
01
"最佳"剂量
有充分的证据显示,阿司匹林较低剂量(75~325 mg/d)与较高剂量(500~1 500 mg/d)相比,抗栓效果相似,但是较少引起副作用。总体上,阿司匹林75~150 mg/d的剂量用于ASCVD长期预防符合"疗效最大,毒性最小"的原则。
降低心脏事件的氯吡格雷最佳负荷剂量/介入术后抗血小板最佳策略研究-7(CURRENT-OASIS 7)募集了17 263例早期接受经PCI的ACS患者,随机纳入阿司匹林75~100 mg/d剂量组和300~325 mg/d剂量组,结果显示两组30 d时主要终点事件(心血管死亡、心肌梗死或卒中)及大出血发生率差异无统计学意义(HR=0.98,P=0.76和HR=1.18,P= 0.20)。
CURE研究结果显示,在阿司匹林+安慰剂组和阿司匹林+氯吡格雷组大出血发生率均随阿司匹林剂量的增加而显著增加。在氯吡格雷治疗组,阿司匹林≤ 100 mg/d、101~199 mg/d和≥ 200 mg/d的大出血发生率分别是3.0%、3.4%和4.9%,3组间差异有显著统计学意义(P=0.000 9)。在阿司匹林剂量较高组,缺血事件并没有额外的获益。
02
不良反应
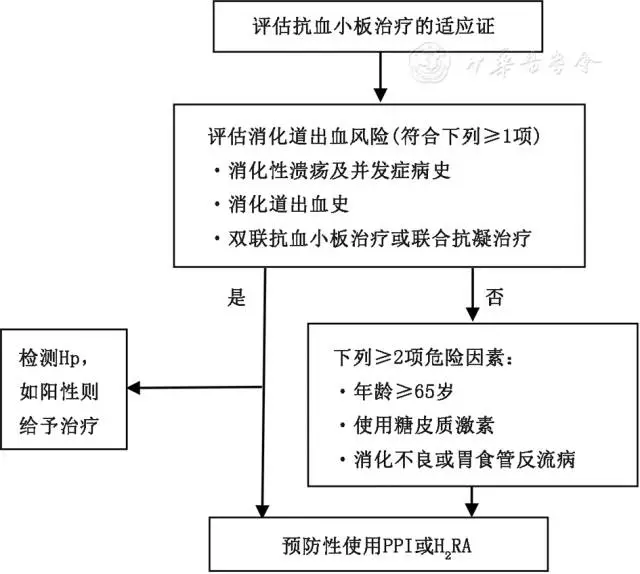
1消化道损伤:
是阿司匹林最常见的不良反应。阿司匹林对消化道黏膜有直接刺激作用,可直接作用于胃黏膜的磷脂层,破坏胃黏膜的疏水保护屏障;同时抑制胃黏膜的COX-1和COX-2活性,导致前列腺素(PG)生成减少,PG主要调控消化道血流和黏膜的功能。PG生成减少是阿司匹林引起消化道黏膜损伤的主要原因。
消化道损伤的常见病变包括消化道黏膜糜烂、溃疡、危及生命的消化道出血及穿孔,以及较少见的肠狭窄等。表现为恶心、呕吐、上腹不适或疼痛、腹泻、呕血、黑便等。服药后12个月内为消化道损伤的多发阶段,3个月时达高峰。
阿司匹林长期治疗者消化道损伤的筛查与预防:
(1)识别消化道损伤的高危人群:
与消化道出血相关的危险因素包括:65岁以上的老年人;有消化道出血、溃疡病史;有消化不良或有胃食管反流症状;DAPT的患者;合用华法林等抗凝药物的患者;合用非甾体消炎药(NSAIDs)或糖皮质激素的患者;存在幽门螺杆菌(Hp)感染、吸烟、饮酒等危险因素者。
(2)合理联用抗血栓药物:
对于出血高危人群尽量避免联合抗血栓治疗。如需进行PCI应尽量选择BMS,以减少DAPT的时间。长期联合应用口服抗凝药物及抗血小板药物时,应将药物剂量调整至最低有效剂量(阿司匹林75~100 mg/d,氯吡格雷75 mg/d,华法林的INR目标值设定在2.0~2.5)。
(3)筛查与根除Hp:
Hp感染是消化道出血的独立危险因素,根除Hp可降低溃疡和出血的复发。目前主要的筛查方法为13C或14C呼气试验。检测前需停用抗菌药物及铋剂至少4周,停用质子泵抑制剂(PPI)至少7 d。建议在长期抗血小板治疗前检测Hp,阳性者应根除。
(4)应用PPI与H2受体拮抗剂(H2RA):
PPI是预防阿司匹林相关消化道损伤首选的药物,疗效优于H2RA。后者对不能使用PPI的患者可考虑应用。消化道出血高危患者可在抗血小板药物治疗的前6个月联合使用PPI,6个月后改为H2RA或间断服用。对高危患者的筛查和处理流程见图2。
图2 预防阿司匹林治疗者消化道损伤的筛查和处理流程
Hp:幽门螺杆菌;PPI:质子泵抑制剂;H2RA:H2受体拮抗剂
(5)随访与监测:
医生和患者均需注意监测和观察消化道不适和出血,尤其在用药最初12个月内,重点是有高危因素的患者。需要注意有无黑便或不明原因贫血。对所有长期接受抗血小板药物治疗的患者进行指导,监测粪便颜色,及时发现柏油样便,每1~3个月定期检查粪便潜血及血常规。阿司匹林消化道损伤的治疗详见相关专家共识。
2出血:
阿司匹林增加出血风险,包括手术期间出血、血肿、鼻衄、泌尿生殖道出血、牙龈出血、皮肤黏膜出血,罕见的有消化道出血、脑出血(血压控制不良的高血压患者或与抗凝药物、NSAIDs、糖皮质激素等合用时)。急性或慢性出血后可能导致贫血、低血压。ACS患者应用阿司匹林合并出血时的防治参考相关共识。严重葡萄糖-6-磷酸脱氢酶(G6PD)缺乏症患者,应用阿司匹林可能诱导溶血或溶血性贫血。
3过敏反应:
最常见的为皮肤过敏反应,表现为皮疹、瘙痒等。此外可能导致支气管痉挛引起剧烈哮喘发作,多在用药数分钟或数小时后出现,表现为服药后先出现鼻部卡他症状,继之出现哮喘,同时伴有黏膜充血、发绀、大汗淋漓、端坐呼吸、烦躁不安,称为阿司匹林哮喘,多为重症。
4水杨酸反应:
长期大量(>3 g/d)服用阿司匹林可产生头痛、眩晕、耳鸣、视听力减退、嗜睡、出汗等反应,称为水杨酸反应,多见于风湿病的治疗,严重者有精神紊乱、酸碱失衡等。
5雷耶综合征(Reye′s syndrome):
是由脏器脂肪浸润所引起的以脑水肿和肝功能障碍为特征的一组症候群,又称脑病合并内脏脂肪变性综合征,多与病毒感染有关,16岁以下少年儿童在感染流感或水痘病毒时服用阿司匹林极易导致雷耶综合征的发生。
6致畸作用:
阿司匹林能通过胎盘,动物试验证实妊娠前3个月应用可致畸胎,如脊椎裂、头颅裂、面部裂、腿部畸形及中枢神经系统、内脏和骨骼的发育不全。
03
阿司匹林"抵抗"
阿司匹林"抵抗"缺乏公认的定义和诊断标准,也缺乏严谨的流行病学数据。通常认为临床阿司匹林"抵抗"是指长期口服阿司匹林治疗但仍然发生血栓栓塞事件;生化阿司匹林"抵抗"是指应用阿司匹林后,实验室指标不能达到预期的抑制血小板聚集效果,如不能抑制TXA2的生物合成和血小板聚集,不能引起出血时间延长等。由于"抵抗"是指药物不能作用于特定的靶点,而血栓栓塞事件的发生是多因素共同作用的结果,血小板的激活和聚集仅是其主要发病环节之一,因此,上述现象称为"阿司匹林治疗失败"或者"阿司匹林治疗中血小板高反应性(high on-treatment platelet reactivity)"更加合理。此处为便于描述,仍沿用阿司匹林"抵抗"这一名称。
除阿司匹林"抵抗"外,服用阿司匹林患者再次发生缺血性血管事件的可能原因还有:
•缺血性血管事件多种危险因素共同干预不力。
•非动脉粥样硬化性血栓引起的血管事件,如冠状动脉栓塞、动脉炎。
•阿司匹林生物利用度减低。
•其他血小板的激活途径,包括血小板的激活途径没有被阿司匹林阻断;血小板对胶原、ADP敏感性的增加;血栓素的生物合成途径不被阿司匹林阻断(例如通过其他有核细胞的COX-2)。
•血小板更新加快,如CABG后、糖尿病。
•基因多态性,如血小板糖蛋白Ⅰa/Ⅱa、Ⅰb/Ⅴ/Ⅸ和Ⅱb/Ⅲa受体的多态性、胶原和vWF受体的多态性、COX-1、COX-2、TXA2合酶或其他花生四烯酸代谢酶多态性及ⅩⅢ因子Val34Leu多态性。
莆田学院附属医院图书馆
您好!您是本站第 43006位访问者